當下的“中國”已成為全球科技界的“熱詞”之一:國際頂級學術期刊為中國科研制作特輯;世界知識產權組織稱贊中國專利“井噴”;“新四大發明”在海外“圈粉”無數……中國創新成為反哺全球醫藥的新動力,世界意義更加凸顯。特別是兩辦發布的關于深化藥品審批制度改革,鼓勵藥品創新和器械創新意見,吹響了中國醫藥創新的號角,我們迎來了醫藥創新的黃金時代。
11月9日上午,秋色宜人的江蘇常州,第29屆全國醫藥經濟信息發布會上,一堂關于醫藥創新生態變革與趨勢研判的頭腦風暴,正在刷新著逾千名醫藥界人士對產業未來的認知。CFDA南方醫藥經濟研究所副所長、醫藥經濟報總編陶劍虹博士在《全球醫藥創新特征與中國趨勢研判》的主題報告中,首次提出了中國醫藥創新步入黃金時代的研判,且讓我們隨著她共同開啟新時代的大門,探看未來醫藥創新藍圖。

CFDA南方醫藥經濟研究所副所長、
《醫藥經濟報》總編 陶劍虹博士
全球醫藥創新生態十大特點
在陶劍虹看來,支撐中國醫藥創新躍升的社會環境和產業基礎已經日臻完善。一方面,中國醫藥衛生事業獲得長足進展,衛生總費用占GDP的比重提高到6%以上,人均衛生費用增長2倍,醫保覆蓋率超過98%,以臨床價值為導向的研發共識已經形成。另一方面,十八大以來的五年,我國醫藥工業規模不斷擴大,醫藥工業總產值占GDP比重也從3.2%增長至4.3%。制藥百強不單追求規模擴大,也更加關注創新投入,尤其是一些創業型研發企業的涌現,成為當下產業創新的活力基因。中國式的創新,融入全球產業變遷中,新的特點格外耐人尋味。
預計2017年至2022年,世界處方藥市場將受到又一輪新藥上市潮的拉動,保持6.5%的年均增長,總規模到2022年將突破一萬億美元。
過去 10 年,全球制藥企業的研發成本增加了80%以上,而新產品的推出量卻減少了43%,全球頂級戰略咨詢公司德國羅蘭貝格管理咨詢公司發布的《醫藥行業如何盈利》報告顯示,被調查的企業中,75%表示他們正經歷戰略危機,而重點發展將放在高增長的新興市場。全球醫藥經濟的增長已經從發達國家轉向新興市場國家。
|
⒉ |
國內外藥審提速,
中國企業迅速跟進FDA新批藥物
|
截至2017年10月30日,FDA共批準了35個新藥,其中4個已在國內CDE有申報。從2016年以來,中國新藥注冊申報量已經占到藥品注冊申報總量的55%。基本消除了藥品注冊申請積壓,等待審評的藥品注冊申請已由2015年8月21668件降至2017年8月的3000件。抗生素和疫苗臨床試驗申請、中藥民族藥注冊申請已實現按時限審評。
表1 2017年FDA新批藥物被國內企業研發跟進情況
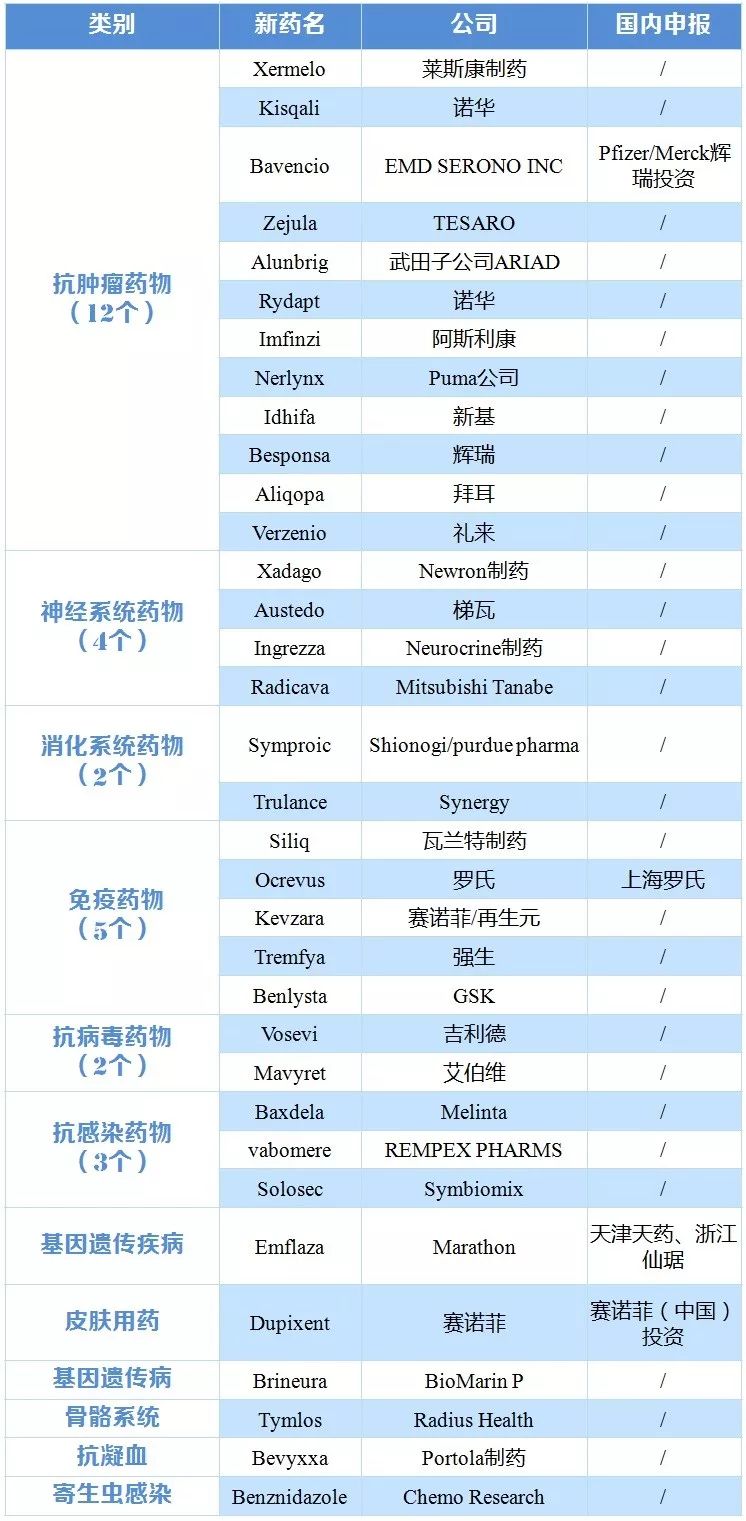
|
⒊ |
國際多中心臨床加快推開,
中國迎來第二次進口藥浪潮
|
新制度下對進口新藥境內上市注冊進行調整,由原先的三報三批改為兩報兩批,進口新藥審評審批加速,2016年共批準22個,2017年1-10月共批準51個。截至2017年8月14日,納入優先審評的進口受理號有144個。進口丙肝新藥集中登陸中國,截至目前,BMS、強生、吉利德、AbbVie的口服丙肝新藥已在國內上市,美國的丙肝市場經歷急速爆發和迅速萎縮,價格競爭日趨激烈,給國內仿制企業也將帶來一定壓力。
表2 獲得優先審評的進口藥物及國內企業跟進情況
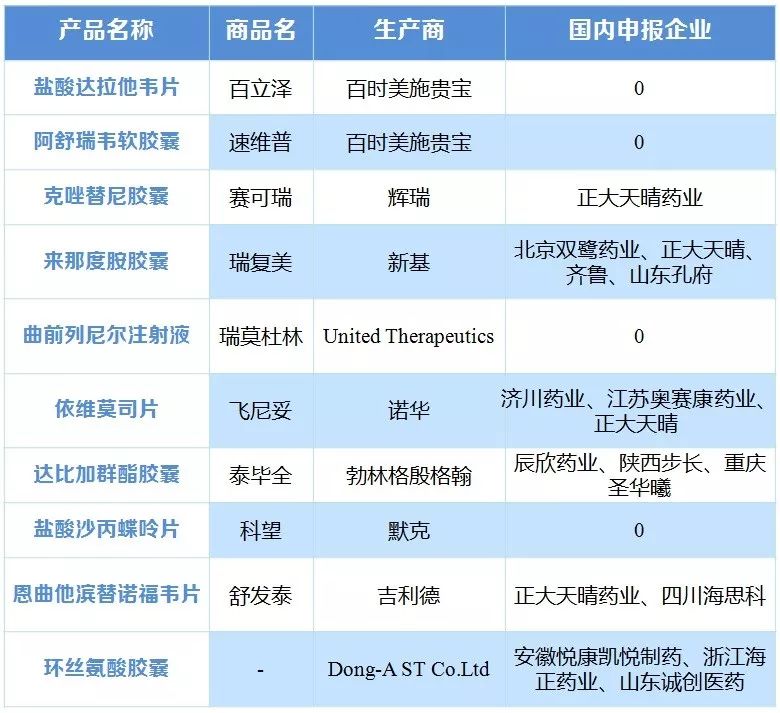
|
⒋ |
中國加入ICH開啟全球研發新格局,
制藥巨頭持續加碼研發投入
|
2017年6月CFDA成為ICH正式成員,通過標準和指南同步,中國的藥品審評審批標準將越發接近發達國家。數據顯示,2017年制藥研發公司的地理分布整體向東部遷移:在華新藥研發企業數量占全球比例從4%(2016年)增長至5%(2017年),中國已成為亞洲最大的新藥研發國。
制藥巨頭藥企持續加碼研發投入,2017年前20強的合計銷售收入占世界藥品市場的比重為41.7%,2017年前20強企業平均研發強度為19.6%
|
⒌ |
新藥的“買來主義”重新流行,
大手筆并購擴充研發管線
|
由于研發的高投入、高風險性,近年來新藥的“買來主義”又倍受關注。其中大型外資企業更是大刀闊行這一措施。如羅氏通過并購驅動公司發展,其收購的藥品銷售額占總銷售額比例從2014年的77%提升至2017年的84%。BMS通過外購潛力品種成為增速最快的公司,預計2020年將有61%的銷售額來自于收購藥品。陶劍虹提示說:并購一般用于企業想要進入新領域的時候,對于企業短期收入提升的貢獻是巨大的,也能分擔過于依賴主營研發方向的風險。但是企業要基業長青,在自己主營業務上的研發投入也是必須的。羅氏能長年有如此穩定的表現,就和自己多年來在腫瘤藥領域的持續投入分不開的,僅2016年就有5個抗腫瘤新藥獲得FDA批準。
表3 近年來成功擴充產品線的并購案例
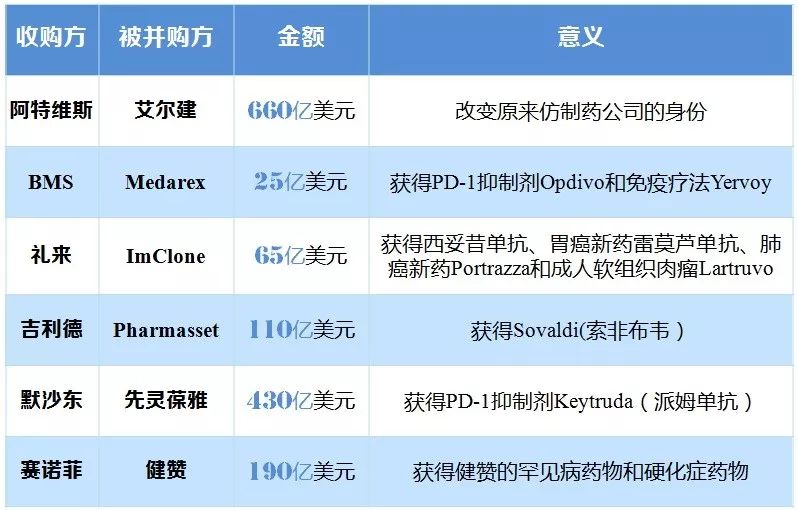
|
⒍ |
外企調整傳統早期研發模式,
與創新型小藥企合作注入新活力
|
近年,外資藥企紛紛關閉或出售中國研發中心日漸頻繁。其主要原因在于大型制藥企業的研發效率不高,傳統研發模式開始變革,轉而與研發效率更高的早期研發型小企業合作。在中國,創新藥企與國外藥企交易合作也逐漸增多,2000年到2016年,中國藥企對外交易合作年平均增長率為19%。
表4 中國藥企與國外藥企重磅交易TOP 10(億美元)
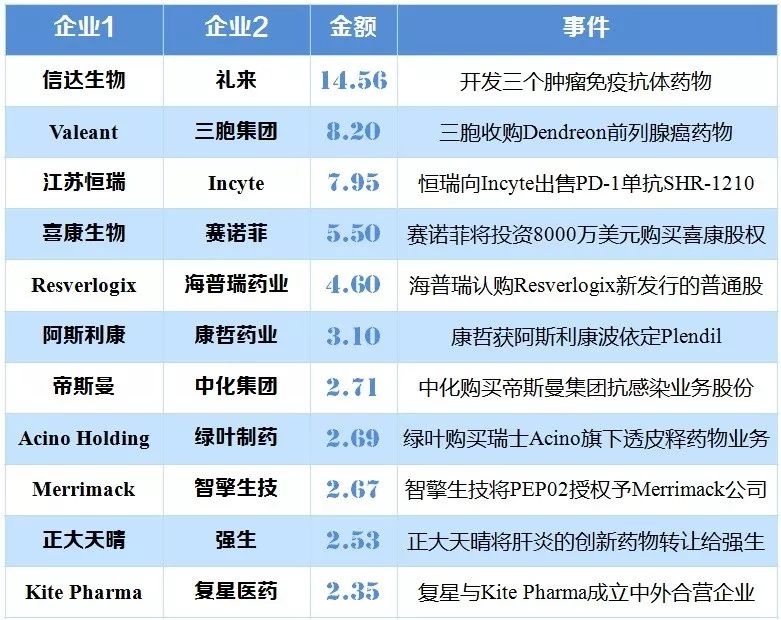
|
⒎ |
MAH銜接初創企業與制藥業,
全球醫藥外包需求上漲
|
目前,全球前10的大藥廠基本都是外部購買創新早期項目、進行后期開發為主。在中國,制藥前50大企業,也紛紛涉足創新藥領域。現階段,中國實施的上市許可人制度(MAH)推動初創企業與制藥企業的協同創新。如BGB-A317注射液,申請人和持有人是百濟神州,受委托企業為勃林格殷格翰生物藥業(中國)。華領醫藥的HMS5552及其片劑,其受委托企業為合全藥業、迪賽諾生物醫藥。國內CMO/CDMO市場由2011年的18億美元增長至今年的50億美元,復合增速達到18.6%。預計到2020年,國內市場規模將達到85億美元,約占全球市場比重的9.7%。
|
⒏ |
仿制藥行業降價壓力增大,
“突破性”仿制藥加快上市進程
|
仿制藥將繼續面臨降價壓力,以梯瓦為例,其股價在2017年8月下跌24%,其核心產品多發性硬化癥藥物格拉替雷面臨專利挑戰,很可能因此失去獨家產品地位,此外梯瓦還受到同類競品Tecfidera的有力競爭。特朗普政府多次抨擊藥品價格過高,FDA開始大大加快仿制藥審批,優先接受超過100種突破性仿制藥的申請,這一舉措增強了市場競爭,同時也降低了藥品價格,預測2017年底美國仿制藥平均降價9%。
陶劍虹著重指出,CDE公布了首批專利過期還沒有仿制藥品的目錄,在激發創新活力的同時,國內適合型藥企可以作參考。
表5 首批專利權到期、終止、無效尚且無仿制申請的藥品清單
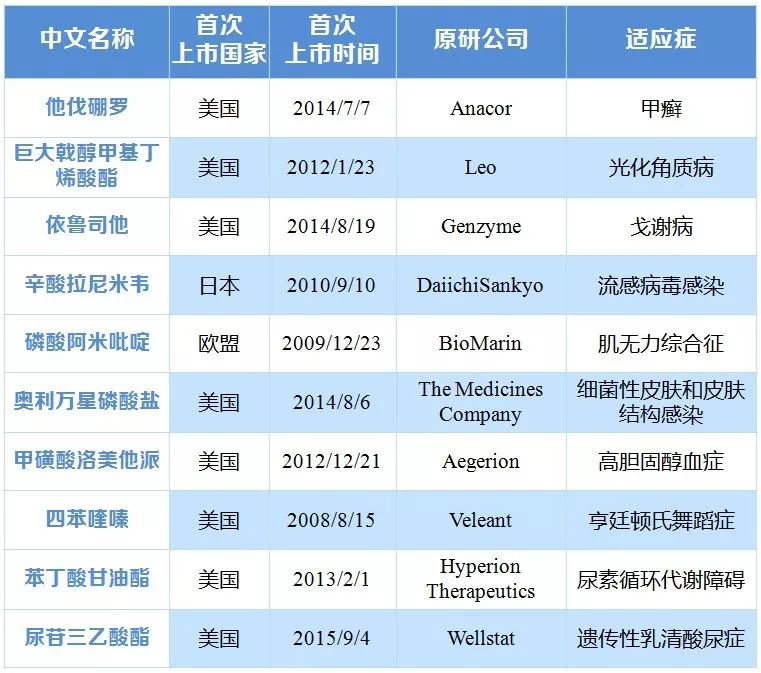
|
⒐ |
生物仿制藥市場方興未艾,
中國在研產品數量領先
|
目前在世界范圍內,有近850種生物仿制藥開發或銷售,其中約125個在臨床試驗。有超過515種改良型生物仿制藥開發或銷售,其中200多個在臨床試驗。大約五年內,生物仿制藥將超過其他創新產品。目前,在研生物類似藥的主要分布地區排名第一的是中國大陸,美國位居第三。一方面反映了中國巨大的市場需求,也反映了中國生物類似藥的激烈競爭。
全世界有80%的在研生物類似藥的適應癥是自身免疫病和腫瘤相關疾病,不論是中國還是從全球,單抗占在研生物類似藥的比例都是最高的,中國達到40.7%。目前,國內不少藥企都在生物類似藥上布局。據湯森路透的報道,2016年蘇州康寧杰瑞在研生物類似藥的數目已有28個之多,其次,齊魯制藥在研生物類似藥數量也達到10個。
2016年全球藥品銷售額Top10中6款單抗藥分別為:貝伐珠單抗、阿達木單抗、曲妥珠單抗、利妥昔單抗、英夫利西單抗和依那西普單抗。其專利在歐盟和美國即將到期(部分在歐盟于2015年和2017年專利已到期)。目前這6款單抗在我國均已有在研企業,貝伐珠單抗類似藥在研企業共14家、阿達木單抗類似藥在研企業共15家、曲妥珠單抗類似藥在研企業共13家、利妥昔單抗類似藥在研企業共6家、英夫利西單抗類似藥在研企業共3家、依那西普單抗類似藥在研企業共7家。
|
⒑ |
孤兒藥研發迎合臨床價值導向,
中國罕見病用藥迎來政策利好
|
現階段全球超過6000種罕見病,獲批的孤兒藥僅有400多個,罕見病用藥缺口較大。陶劍虹分析說,孤兒藥研發的具有自身優勢,一是所需病人較少,不少在二期臨床完成后就可以上市。二是孤兒藥研發的成功率三倍于一般藥物研發。三是上市后的商業推廣費用低,加上7-10年的獨占期,使其他仿制藥廠無法跟隨。四是孤兒藥在上市后可以拓展新的適應癥,商業價值很大,易變為重磅產品。
據預算,全球孤兒藥的銷售總額在2022年將達2090億美元。中國2017年也將通過發布罕見病目錄、優先審評審批、條件性允許境外新藥上市以及醫保準入等加速孤兒藥研發上市。開放孤兒藥將是國內企業值得關注的領域。
小結
醫藥創新進入黃金時代
陶劍虹在梳理了全球醫藥創新生態十大特征之后,指出:中國醫藥創新正步入黃金時代,這個內涵具體包括:
伴隨著未來人口老齡化、居住城市化、人們健康意識增強以及疾病譜變化,促使醫藥需求持續增長。未來5-10年是醫藥發展的關鍵時期,也是大有可為的戰略機遇期。
未來醫藥研發將進一步發生價值鏈重構,資源全球配置。從實驗室到臨床研,從藥企到研發外包,從資本孵化到上市,需要形成多方融合的創新生態系統。故新藥的“買來主義”重新流行,大手筆并購擴充研發管線。
鑒于仿制藥特征,“突破性”仿制藥加快上市進程,生物類似藥大品種市場方興未艾,中國市場通過“質量和療效一致性”的仿制藥將成主流。
中國加入ICH將開啟全球研發新格局,研發投入持續加碼,國內外藥審提速,新藥上市加快以滿足臨床需求。
中小型生物醫藥公司的崛起,致使某些大型藥企調整傳統早期研發模式,與專注研發型公司注資委托授權合作。
與國際主流對比,差距與挑戰依然存在,中國將迎來第二次進口藥品熱潮,市場競爭會變得愈發激烈,進口替代,超越競爭的新模式隨之而生,在競爭中成長和成熟。
聚焦凸顯臨床價值三大品類
抗腫瘤用藥:
免疫療法異軍突起
全球腫瘤藥市場預計達1500億美元,預測腫瘤藥花費到2020年的年增長率為7.5%-10.5%。從全球不同地區的抗腫瘤市場來看,美國最大,其次是歐盟和日本市場,含中國在內的新興市場則保持逐年擴增。在中國醫院用藥市場,抗腫瘤藥物的銷售規模近幾年來穩步增長,2016年中國腫瘤藥市場銷售1069億元,增長10.2%。
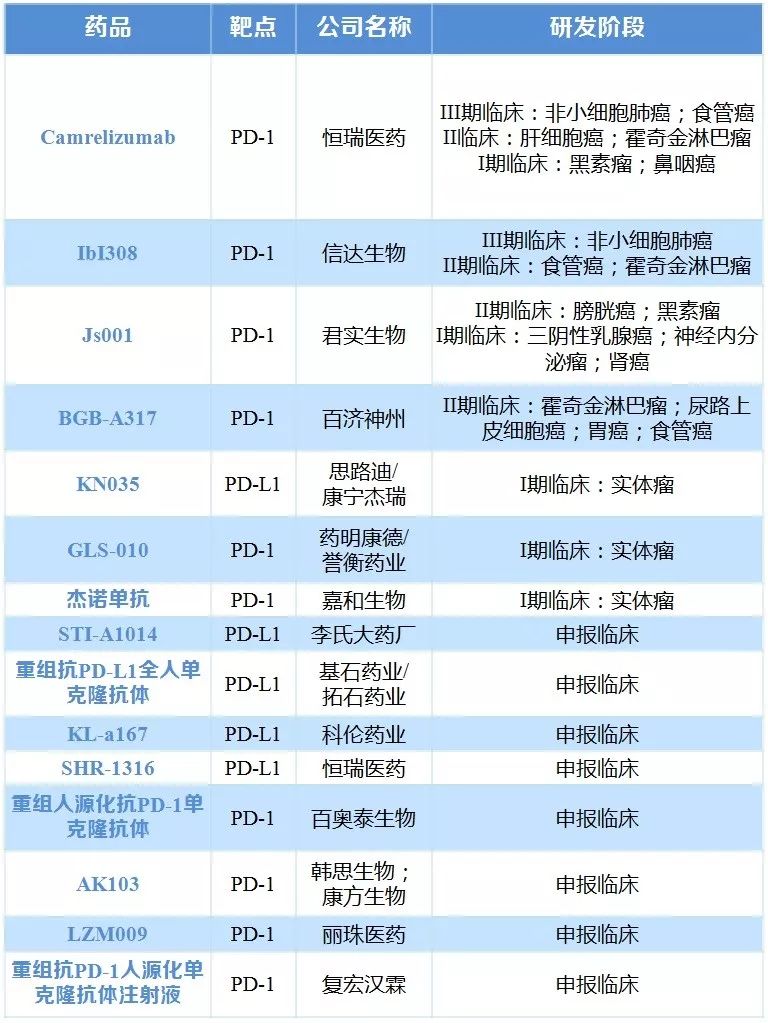
研發進展來看,2017年1-10月FDA批準上市的抗腫瘤藥有12個,國內批臨床的抗腫瘤1類新藥(15個)。現階段PD1/PDL1市場增長迅速,2016年市場份額約60億美元。該類原研藥也逐漸進入我國市場,與此同時,研發繼續呈現火熱。
表6 國內企業申報的PD1/PD-L1藥物及研發階段
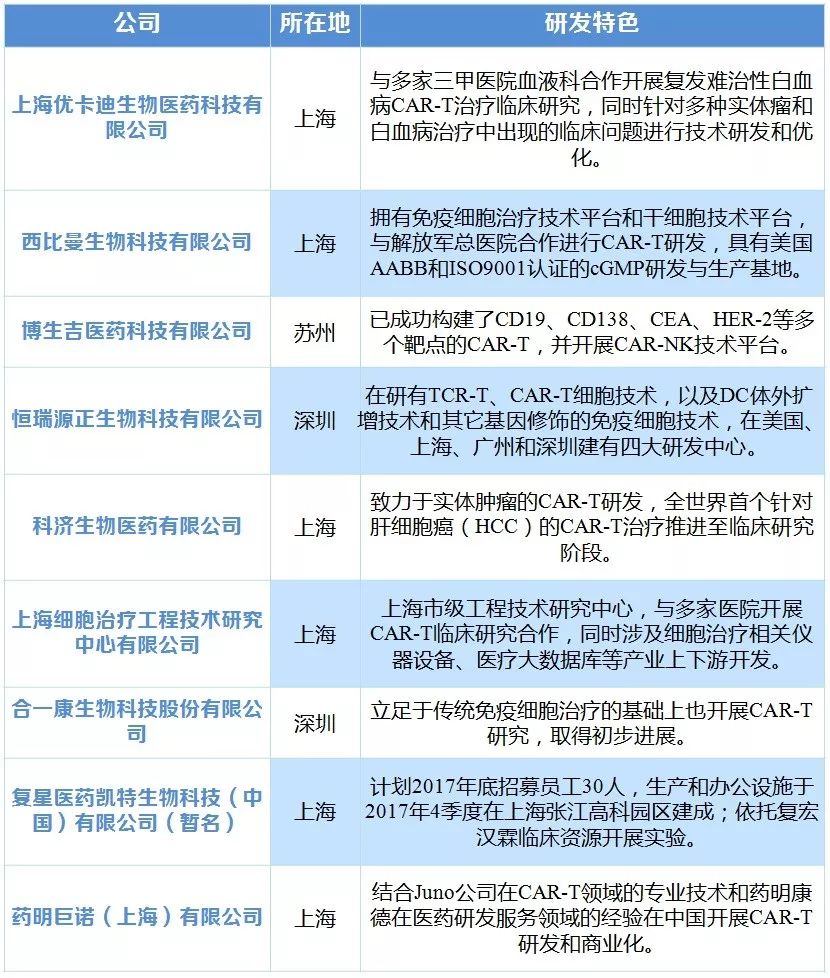
腫瘤的CAR-T療法讓腫瘤治療進入嶄新時代,美國是CAR-T療法的發源地,不僅上市了首款CAR-T療法,其臨床試驗進行數量也遙遙領先(97項)。中國已躋身CART研發第一團隊,以66項臨床試驗數量位居第二,目前國內已有多家企業CAR-T 研發項目推進至臨床階段。未來CAR-T全球血液腫瘤市場有望達117 億美元,國內血液腫瘤市場有望達111億元。
表7 國內多家企業正在進行 CAR-T 研發
降血脂用藥:
PCSK9抑制劑方興未艾
降血脂用藥醫院銷售集中度較高,他汀類制劑占降血脂用藥91.8%,以外企為主,阿托伐他汀和瑞舒伐他汀合計占了整個他汀類僅8成市場。
PCSK9 抑制劑是“后立普妥時代”最強大的降脂新藥,2015年7月24日FDA首個批準上市的PCSK9抑制劑商品名為Praluent(通用名:阿利庫單抗),原研廠家是賽諾菲/再生元;歐盟首個上市的PCSK9抑制劑是在2015年7月22日,商品名為:Repatha(通用名:依伏庫單抗),原研廠家是安進,同年8月27日獲得美國FDA批準。安進的依伏庫單抗已于2015年9月在中國獲得臨床批件,賽諾菲/再生元的阿利庫單抗也于2015年12月獲得臨床批件,目前都在我國進行國際多中心Ⅲ期臨床研究,國內同類品種西威埃的CVI-LM001片已于2016年3月拿到臨床批件,君實生物的PCSK9單抗注射液在2017年7月拿到臨床批件。
糖尿病用藥:
胰島素長盛不衰
到2040年,糖尿病相關醫療費用將突破8020億美元。目前,糖尿病用藥已躍居全球藥品銷售排行第二位,僅次于腫瘤用藥。根據IMS 統計,2015 年全球糖尿病藥物市場中,胰島素產品約占56%、GLP-1 受體激動劑類藥物約占10%、DPP-4 抑制劑類藥物占24%、SGLT-2 抑制類藥物占5%、其他傳統小分子降糖藥占4%。
我國口服糖尿病用藥中,列汀類屬DPP4抑制劑,是近年來較受關注的分支領域,現臨床基本為外企產品。國內多家企業已紛紛進行研發,如江蘇恒瑞的瑞格列汀、江蘇豪森的貝格列汀、山東綠葉的艾格列汀等等,均在申報中,未來會有較多相關產品獲批上市;格列奈類在臨床上現僅有三個品種,國內企業競爭力在不斷提升。
醫藥產業未來研判十大趨勢
陶劍虹對醫藥創新從宏觀到微觀的分析,吸引了與會代表的極大關注,她對中國醫藥產業未來十大趨勢的研判,進一步揭示了一個創新年代的活力圖景。陶劍虹指出,隨著云計算、物聯網、大數據、人工智能等新技術登上舞臺,中國已經站在了第四次產業崛起領跑者的位置上。新一輪技術變革的核心是智能化與信息化。消費升級觸發上游裂變,以智能化為核心的新制造,以O+O為路徑的新零售,在融合中催化中國醫藥經濟的重構升級。
互聯網+大健康,新實業+新技術,新制造+新零售,傳統與新銳、科技與人文、智能與匠心,正在變革中共振,拓展著中國醫藥產業的向上空間!
在2017年的深秋,我們不難感受到下一個暖春的氣息,如何在下一輪周期波動中拐點向上,政策紅利與轉型壓力,考驗著中國醫藥經濟的韌性,而日益活躍的創新平臺與資本流量,為產業發展增添了張力。具體表現在:
1
消費升級是值得期待的風口
消費逐漸成為經濟增長的第一驅動力,2016年最終消費對經濟增長貢獻率達到 64.6%,未來提升空間仍然巨大。最近十年大量的醫保投入和居民收入的增加,使得“因病致貧”已經大量減少,腫瘤從治療角度,心腦血管從早期預防與治療角度已經有很大改觀,未來市場需求將繼續提升。同時消費升級使得專科用藥市場受益,專科藥物就診量小,藥品利潤高,例如:類風濕在我國發病人群每年在500萬以上,屬于不死的癌癥,在發達國家治療概率非常高,而在國內治療率也僅僅在10% ,還有很大的成長空間。
2
VR和AI會刷新研發效率
越來越多的高科技被藥企應用于新藥研發領域,借此探索提高新藥研發效率、節省更多成本的路徑,如:應用于藥物研發項目的輝瑞365平臺上描述的VR系統名為輔助虛擬環境(CAVE),用投影儀打造虛擬現實場景,讓研究人員更快捷的探索數據。強生倫敦創新中心將一些處于試驗中的小分子化合物轉交給了BenevolentAI公司進行開發,利用人工智能系統來指導臨床試驗的進行和數據的收集。日本的鹽野義制藥等近50家日本企業將參加利用人工智能推進新藥開發的項目。
3
醫藥新實業轉型重塑
醫藥新實業的轉型需提高三大能力:整合營銷能力、供應鏈能力、金融資本能力。同時,制藥工業與工業4.0逐步融合。“工業4.0”使制造業模式可以從傳統的以產品為中心向以用戶為中心轉變,其中包括生產模式從大規模流水線生產轉向定制化規模生產轉變。但是由于制藥行業產品(藥品)的特殊性,一般不可能依據消費者(患者)的喜好來定制化生產。不過,制藥裝備就可以有定制化的需求,尤其3D打印技術在醫藥領域的運用發展較快。
4
供應鏈創新促醫藥流通升級
2017年10月,國務院辦公廳印發《關于積極推進供應鏈創新與應用的指導意見》,指出“推動流通創新轉型、推進流通與生產深度融合和提升供應鏈服務水平”。為例藥品流通企業利用物聯網、區塊鏈等技術,建設供應鏈一體化管理平臺,打通物流、資金流和信息流的隔閡;向供應鏈上下游提供市場開發、價格談判、在線支付、金融支持等增值服務及綜合解決方案,借助云計算、大數據等技術挖掘數據的價值,輔助企業及終端客戶的經營決策,從根本上解決信息孤島問題。
5
O+O全渠道開啟醫藥新零售時代
信息技術的充分發展為新零售提供強大保障,電商巨頭借助信息技術實現消費者為中心的線上線下數據全面打通已經成為可能,也為新零售模式下以消費者為中心重構人、貨、場提供強大保障。由此,醫藥O+O將會逐漸成為中國零售藥店轉型的主流選擇。
隨著處方外流加速,國內DTP藥房將迎來發展良機。預計到2020年,DTP的市場容量將接近400億元。隨著創新藥加速上市,慢病和腫瘤等自費治療性用藥比例提升,DTP藥房逐步由經營新特藥向專科藥演變,將憑借其專業的用藥咨詢服務等優勢,成為處方外流的主要承接方之一。
6
工商企業大融合時代到來
陶劍虹把上游工業企業,按照科技含量和產品價格的維度,切出了五類的醫藥企業,分別是2000家到3000家僵尸企業、低成本高質量的加工能力強的生產企業、有獨特產品的特異性中小型企業、綜合性大型企業 、大型外企。這五類醫藥企業里面其實都已經完成了自己的定位。中國企業戰略資源的配置是重視營銷和生產的配置,而國際大中型企業典型資源配置是重視研發和營銷的配置。兩票制、營改增的時代,是工商企業高度融合的時代!戰略理念的契合匹配是持續發展走的更遠的基礎。邊界正在消失,研發和營銷可以是一體的,一個有創新力的企業一定是富有營銷活力的企業!
7
研發創新產業集群形成,灣區經濟將凸顯
在全球范圍內醫藥研發產業集群正在逐步形成和聚合。灣區經濟作為重要的濱海經濟形態,是當今國際經濟版圖的突出亮點,是世界一流濱海城市的顯著標志。2017年 “粵港澳大灣區”首次出現在《政府工作報告》。相比紐約灣區、東京灣區、舊金山灣區等世界著名的幾大灣區,粵港澳大灣區的GDP總量還不夠大,人均GDP更少,梯度差異仍然明顯。粵港澳大灣區將成為新的驅動發展模式、改革開放的升級版。
8
高性能醫療器械產業發展圖景逐漸清晰
《中國制造2025 重點領域技術路線圖》提出到2030 年我國醫療器械產業規模要達到3 萬億并完成1 萬億的出口目標,則未來15 年該行業至少將保持約16.39%的復合增速。我國醫療器械消費占比遠低于國際平均水平,具有廣闊的成長空間。預計在國家對醫療器械國產化政策的大力推動下,高端國產醫療器械將獲得長足發展。基層和非公立醫療機構的醫療器械市場空間廣闊,家用醫療器械市場預計也將快速增長。
9
中國大健康產業蓬勃發展
美國健康產業是近十年來增速最快的產業,占GDP的比重為8.8%。中國大健康產業占GDP的比重為5.6%。陶劍虹指出:和美國相比,中國的大健康產業處于初創期,醫藥產業尤其是醫藥制造部分的占比很重,健康服務產業發展還有很大空間,在產業細分以及結構合理化方面需要更大的提升和完善。
特醫食品是大健康產業的下一場盛宴。《特殊醫學用途配方食品注冊管理辦法》 2016年7月1日正式實施,海外特醫食品巨頭、國內企業尤其是制藥企業躍躍欲試,特醫食品迎來了其發展的新機遇。隨著中國社會老齡化加速,中國特醫食品未來的市場規模將超過100億元。
10
“健康中國”帶動醫養結合快速發展
陶劍虹在最后指出,令人倍感振奮的是,十九大報告提出“健康中國”戰略。明確了人民健康是民族昌盛和國家富強的重要標志。“大健康”理念將從理論付諸實踐、醫療衛生體制改革將全面破解世界難題、從田野到餐桌的食品安全防線將全面構建,為全體國民描繪“健康中國”的實施路線圖。未來,國家將積極應對人口老齡化,構建養老、孝老、敬老政策體系和社會環境,推進醫養結合,加快老齡事業和產業發展。智慧養老將是醫藥企業值得關注的跨界整合領域。
重拾創新初心的“漂亮”哲學
陶劍虹如此全景式的展望中國醫藥產業的廣闊前景,令醫藥人心潮起伏,但她同樣也提示大家直面中國醫藥創新的冷峻現實。創新沒有完美的終點,需要在壓力下優雅前行。創新需要外部的激勵,更需要參與創新的人不斷給自己激勵。陶劍虹娓娓道來:“關于這一點,我想說兩個有趣的故事,傳說蝸牛從前是沒有殼的,但他爬到上蒼那里去,祈求上蒼賜給它一個殼。 為什么一定要裝美麗的殼呢?虛偽還是自欺欺人? 蝸牛沉思片刻,鄭重回答:為了僅此一次的生命。在激烈的市場競爭中,中國企業還沒有自信承受多次的研發失敗,因為太多的不確定性讓企業沒有足夠的定力,為了創新僅此一次的生命,讓我們給新藥研發更好的孵化器,讓脆弱的藥物創新受到多一些保護。”
在陶劍虹看來,創新這條路并不歡迎悲情英雄,新藥研發的探索者要有一種牽著蝸牛散步的豁達。借用“反脆弱”的理念,就是要勤于實驗,廣泛播種,著眼長期,靈活轉向,簡勝于繁,總結反思。
而她援引的另一個故事描述的是原本善于飛翔的蝸牛獲得飛行比賽的冠軍之后,不思進取,自我陶醉,結果翅膀退化,獎杯成了堅硬的外殼,只能在地上爬行。她意味深長地說:“這是一個警醒,即使在研發的道路上你已經走得很遠,也不能忘記當初為何出發。既然選擇了遠方,便只顧風雨兼程;我們只需確定,守住最初的浪漫,要贏就贏得漂亮。”
■記者 董菊紅
■編輯 陳麗
本網站所有信息僅供參考,不做個別診斷、用藥和使用的根據。本網站致力于提供正確、完整的健康內容的真實性,我們不對其科學性、嚴肅性等作任何形式的保證。如其他媒體、網絡或個人從本網下載使用須自負版權等法律責任。
本網站所有信息僅供參考,不做個別診斷、用藥和使用的根據。本網站致力于提供正確、完整的健康資訊,但不保證信息的正確性和完整性,且不對因信息的不正確或遺漏導致的任何損失或損害承擔責任。本站所提供的任何醫藥資訊,僅供參考,不能替代醫生和其他醫務人員的建議,如自行使用本網資料發生偏差,本站概不負責,亦不負任何法律責任。
